由于凝胶浓度决定凝胶孔径的大小,而凝胶孔径影响电泳效果(即凝胶的分子筛效应),所以应根据样品中蛋白质的分子量范围选择合适的凝胶浓度。如下:
| 蛋白分子量大小(kDa) | 凝胶百分比(%) |
| 12-45 | 15 |
| 15-60 | 12 |
| 20-80 | 10 |
| 30-120 | 8 |
| 60-200 | 6 |
配胶时需注意以下几点:
1.玻璃板清洗后,为了使表面的水快速晾干,可以在烘箱中放置几分钟,拿出来的时候一定要晾到室温再灌胶,不然很容易产生气泡;
2.夹胶板时,玻璃板要对齐,以免漏胶。灌胶前可以加入少量水检漏或者用配好的分离胶溶液封边。
3.过硫酸铵的作用是提供自由基引发丙烯酰胺和亚甲基双丙烯酰胺的聚合反应,故一定要新鲜配制或者适当低温保存。室温贮存过久的过硫酸铵溶液不能使用。此外,10%的过硫酸铵溶液要现用现配,4度冰箱贮存建议不超过7天。
4.加水/无水乙醇液封时,速度要慢,可用1ml移液器,甚至使用0.2ml移液器沿着胶板上沿反复移动,不然很容易将分离胶冲变形。液封的目的是使分离胶上表面平直,并排除气泡。
5.样品梳需一次平稳插入,梳口处不得有气泡,梳底需水平。
6.在实验过程中,除了均一浓度胶,梯度胶也经常被使用。梯度胶比单一浓度凝胶的分离范围更宽,可以同时分离较大范围分子量的蛋白质。另一个优点是梯度胶可以分辨分子量相差较小,在固定浓度胶中不能分辨的蛋白质。
为了使实验过程更加方便,碧云天提供配胶所需的各种预混液,凝胶快速、超快速配制试剂盒及预制胶等产品。
关于凝胶配制试剂盒的选择
SDS-PAGE凝胶配制试剂盒提供了配制SDS-PAGE凝胶所需的各种试剂,用户只需自备制胶器具和蒸馏水,即可配制PAGE胶(即聚丙烯酰胺凝胶)。
SDS-PAGE凝胶快速配制试剂盒把凝胶配制所需的缓冲试剂、SDS等预混合成下层胶缓冲液(4X)和上层胶缓冲液(4X),简化了凝胶配制的步骤。下层胶缓冲液中含Tris pH8.8及适量SDS,上层胶缓冲液中含Tris pH6.8及适量SDS。
SDS-PAGE凝胶超快速配制试剂盒以及凝胶预混液把凝胶配制所需的Tris-HCl、Acr-Bis(29:1)、SDS等预混合成下层胶预混液和上层胶预混液,使用前仅需加入适量10%凝胶聚合催化剂(过硫酸铵或其替代物)和TEMED即可简单快速地完成下层胶(分离胶)和上层胶(堆积胶)的配制。
大家可以根据自己的实验需求选择合适的配胶试剂盒,也可以选择更加便捷的预制胶产品。更多关于凝胶超快速配胶试剂盒和预制胶的信息请点击链接。
凝胶超快速配胶试剂盒:(点我查看)
预制胶:(点我查看)
2、上样
上样时需要注意:
1.内槽补满电泳液后再拔梳子;
2.加样前每个孔如果能用移液器吸入电泳液轻轻吹打一下,会使电泳效果更佳。
3.可在蛋白变性前调整蛋白浓度,使上样量尽量保持一致。如果已经变性的蛋白浓度本身不一致,可以通过加入1X蛋白上样缓冲液调整。此外,上样量不要太多,以避免渗漏到邻近加样孔。
4.加样前,样品都需要充分煮沸。如果有明显的沉淀物或悬浮物(常见的包括可能结合了一些蛋白的基因组DNA,特殊细胞或组织中的不溶物等),需要离心去除,以免干扰蛋白电泳或者使上样量不太均匀。
5.每次电泳时需要使用预染蛋白质分子量标准(蛋白marker)来观察电泳效果和转膜效果,以及判断蛋白分子量大小。推荐使用彩色预染蛋白质分子量标准以便更加方便直观地观察。
6.为了确保Western blot结果的准确性和特异性,可以考虑设置合适正确的对照,具体如下——
阳性对照:明确表达检测蛋白的组织或细胞,用于检测抗体的工作效率和实验操作的正确与否;
阴性对照:明确不表达检测蛋白的组织或细胞,用于检测抗体的特异性;
碧云天提供多种蛋白上样缓冲液和蛋白分子量标准等产品,供大家选择。
| 产品编号 | 产品名称 | 产品包装 |
| P0015/0015L | SDS-PAGE蛋白上样缓冲液(5X) | 2ml/15ml |
| P0015A | SDS-PAGE蛋白上样缓冲液(1X) | 10ml |
| P0015B | SDS-PAGE蛋白上样缓冲液(2X) | 5ml |
| P0015F | SDS-PAGE蛋白上样缓冲液(6X) | 2ml |
| P0016 | 非变性PAGE蛋白上样缓冲液(5X) | 2ml |
| P0016N | 非变性非还原性蛋白上样缓冲液(5X) | 2ml |
| P0060S/M | 蛋白质分子量标准(10-150kD, 非预染) | 200ul/1ml |
| P0061/62 | 蛋白质分子量标准(14.4-116kD, 非预染) | 200ul/1ml |
| P0063 | Protein Ladder (10-200kD, 非预染) | 100ul |
| P0066/0067 | 预染蛋白质分子量标准(19-117kD) | 200ul/1ml |
| P0068/69 | 彩色预染蛋白质分子量标准(10-180kD) | 200ul/600ul |
| P0071/0072 | BeyoColor™彩色预染蛋白分子量标准(6.5-270kD) | 200ul/600ul |
| P0075/0076 | BeyoColor™彩色预染蛋白分子量标准(10-170kD) | 200ul/600ul |
| P0078/79/80 | BeyoColor™彩色预染蛋白分子量标准(15-120kD) | 200ul/600ul/3ml |
| P0059-200μl | Recombinant 16-Tag Protein | 200μl |
| P0059-1ml | Recombinant 16-Tag Protein | 1ml |
3、电泳
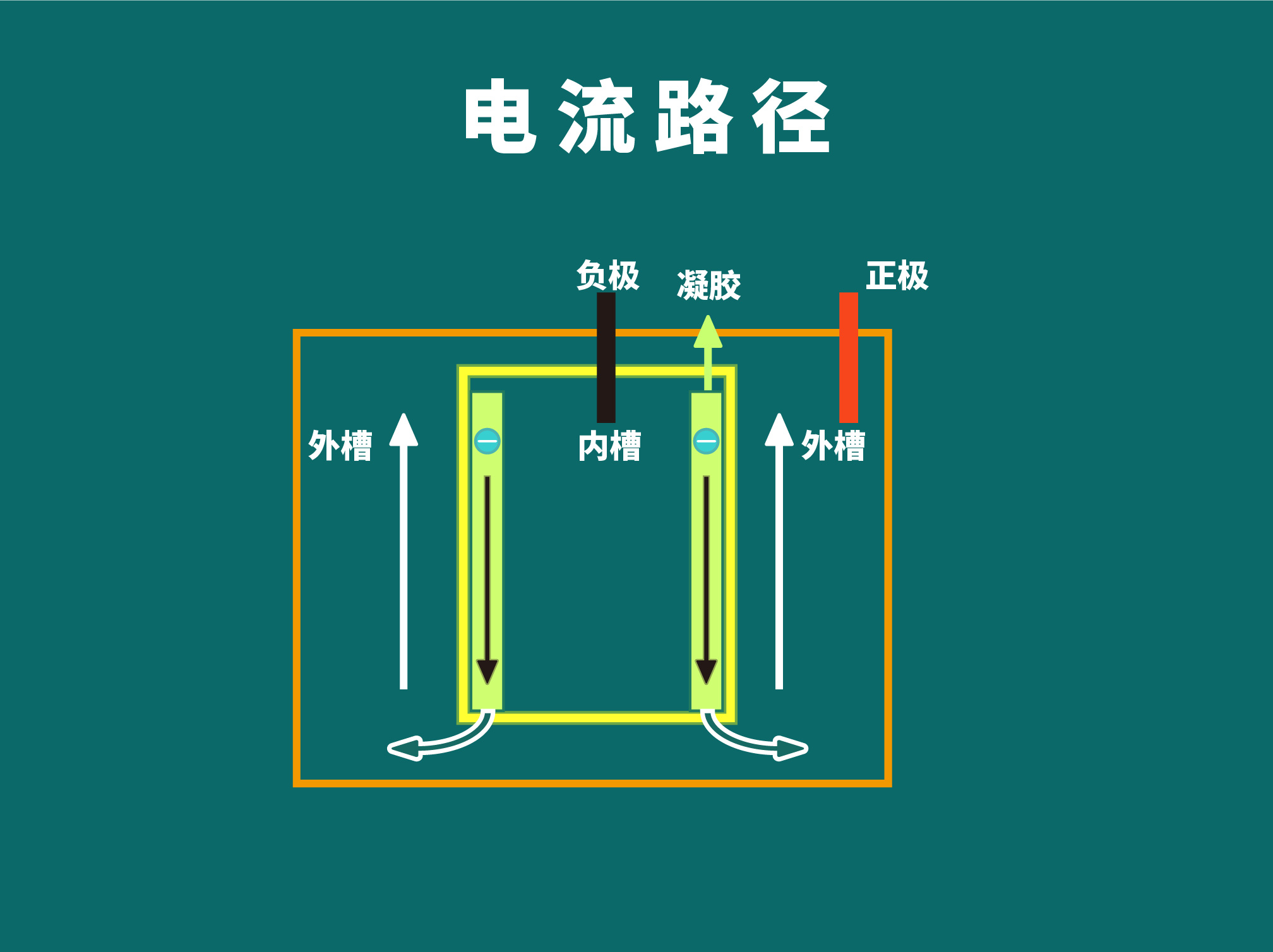
1.上样后应尽快开始电泳,以减少小蛋白条带的扩散;
2.电泳时通常推荐在上层胶时使用低电压恒压电泳,使样品跑得慢一些,充分浓缩而在溴酚蓝进入分离胶时使用高电压恒压电泳。实际过程中也可以采用恒电流模式,可根据自己的时间来调节。电泳至溴酚蓝靠近凝胶底部即可终止电泳,或者可以根据预染蛋白质分子量标准的电泳情况,预计目的蛋白已经被适当分离后即可停止电泳。
3.关于电泳液,也可以回收1-2次作为外槽电泳液,根据实验室情况决定。内槽电泳液请每次新鲜配制。建议先配10x的,然后现用现稀释。
除了电泳缓冲液外,碧云天还有高品质制胶、电泳设备和耗材供大家选择。
4、SDS-PAGE中常见问题
Q 1.蛋白胶凝固不好,很长时间才凝固?
A 加大TEMED及过硫酸铵的用量,使胶的凝固速度加快。确保玻璃板洗干净,防止玻璃板上有干胶或残留物附着。
Q 2.蛋白胶不凝固?
A 加大TEMED或过硫酸铵的用量;胶凝固时放置于37℃或强光处;使用新鲜配制的过硫酸铵,过硫酸铵放置时间过长极易失效。
Q 3.胶凝固时间过长或太快?
A 如果凝胶时间过长,可能是TEMED及过硫酸铵用量偏少、过硫酸铵部分失效、室内温度过低或者配制凝胶处缺乏适当亮度的灯光或自然光。胶凝固需要适量的TEMED及过硫酸铵,也需要适当的温度和光照。如果凝胶时间太快,可能是TEMED及过硫酸铵用量太多,此时胶会比较硬。
Q 4.为什么目的蛋白跑得过快或过慢?
A 我们在实验中常希望目的蛋白跑到分离胶的接近中间的地方,但经常会遇到目的蛋白跑到了分离胶的接近最上边或者接近最下边处甚至跑到了胶外边。处理办法:选择适当的分离胶浓度;蛋白煮沸处理时确保蛋白变性充分;蛋白质分子量过大时可以适当延长电泳时间,甚至可以让溴酚蓝跑出胶外;蛋白质分子量过小时,可以适当缩短电泳时间,有时溴酚蓝电泳至分离胶的1/2或2/3处就可以停止电泳。
Q 5.浓缩胶与分离胶断裂、板间有气泡对电泳有影响吗?
A 这主要出现在初学者中。出现类似情况时,建议重新配制凝胶。前者主要是拔梳子用力不均匀或过猛所致。后者主要是由于在解除制胶的夹子后,板未压紧而导致空气进入引起的,或者是配制好的凝胶放置时间过长导致部分失水而产生气泡的。
Q 6.目的条带和“杂带”靠得很近怎么办?
A SDS-PAGE后进行WB检测时,经常会遇到目的条带和“杂带”靠得很近的情况,即使是经常做WB的实验人员也是非常头疼的事情。
处理办法:选择适当浓度的分离胶,使目的条带检测时采用的是最适合目的条带和杂带分离的凝胶浓度,并且充分延长电泳时间,直至目的条带电泳至接近分离胶的底端。此时溴酚蓝通常早就被电泳至分离胶外,而目的条带和“杂带”也可以被充分地分离开。可以使用预染蛋白质分子量标准来判断目的蛋白电泳的位置。