|
|||||||||
产品简介
产品简介:
| 产品编号 | 产品名称 | 产品包装 | 产品价格 |
| S0025 | 一氧化氮合成酶检测试剂盒(荧光法) | 100次 | 906.00元 |
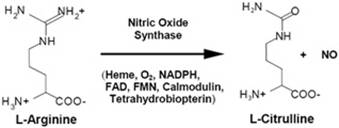
一氧化氮合成酶检测试剂盒(Nitric Oxide Synthase Assay Kit)可以检测活细胞内总的一氧化氮合成酶的活性。如果和特异性的一氧化氮合成酶抑制剂配合使用,也可以检测不同类型的一氧化氮合成酶的活性。
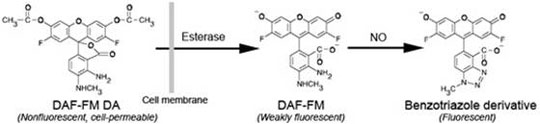
本试剂盒提供了一种在生理条件下通过荧光检测活细胞内一氧化氮合成酶活性的方法,不需要使用传统方法所需的放射性同位素。本试剂盒采用了可以穿透细胞膜的最新一代一氧化氮荧光检测探针DAF-FM DA(3-amino,4-aminomethyl-2',7'-difluorescein, diacetate),在提供充足的底物的条件下检测细胞内的一氧化氮合成酶可以催化产生的一氧化氮量,从而检测出一氧化氮合成酶的活性。详细的检测原理参考图1。采用一些一氧化氮合成酶的抑制剂则可以测定出特定类型的一氧化氮合成酶的活性。例如,采用iNOS抑制剂,未加iNOS抑制剂测定出来的酶活力减去加了iNOS抑制剂测定出来的酶活力就是iNOS的酶活力。
本试剂盒是目前为止世界上最先进的一种一氧化氮合成酶检测试剂盒。和Calbiochem等多年前就开始提供的一氧化氮合成酶检测试剂盒相比无需使用同位素,和Sigma等最近推出的基于荧光的一氧化氮合成酶检测试剂盒相比采用了最新一代的荧光探针,灵敏度更高,特异性更好。本试剂盒的缺点是和其它荧光法一氧化氮合成酶检测试剂盒一样,仅能提供一氧化氮合成酶的相对活性。
本试剂盒和检测细胞内一氧化氮水平的不同之处在于提供了充足的底物L-Arginine和一些可以穿透细胞膜的反应辅助因子,确保一氧化氮合成酶的催化的一氧化氮合成不会受底物的量或辅助因子的量的限制,从而可以测定出细胞内一氧化氮合成酶活力。
本试剂盒最适合用于贴壁的细胞或组织的一氧化氮合成酶的检测,对悬浮细胞也可以进行检测。
本试剂盒可以测定100个样品。
包装清单:
产品编号 |
产品名称 |
包装 |
S0025-1 |
NOS检测缓冲液(2X) |
15ml |
S0025-2 |
精氨酸溶液 |
600μl |
S0025-3 |
NADPH |
2.3mg |
S0025-4 |
DAF-FM DA(5mM) |
20μl |
— |
说明书 |
1份 |
保存条件:
-20℃保存,DAF-FM DA需避光保存,半年有效。
注意事项:
RPMI 1640等含有较高浓度硝酸盐的培养液容易对本试剂盒的检测产生干扰,请尽量避免。
由于检测过程中有还原反应,凡是影响还原反应的氧化或还原试剂要注意避免,例如常用的还原剂
DTT和巯基乙醇。
DAF-FM DA在4℃、冰浴等较低温度情况下会凝固而粘在离心管管底、管壁或管盖内,可以20-25℃水浴温育片刻至全部融解后使用。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明
使用说明:
1. 细胞或组织培养:
把待检测的细胞或组织培养到96孔板内,通常以培养16-24小时后细胞为80-90%满为宜。可以留至
少一个孔作为没有细胞的空白对照。
2. 试剂的准备:
NADPH溶液的配制:加入1ml MilliQ级纯水,充分溶解并混匀,配制成2.5mM的NADPH溶液。分装
成小管,当日不使用的立即-70℃冻存。取适量2.5mM NADPH,用NOS检测缓冲液稀释成0.1mM
NADPH。
NOS检测缓冲液的配制:取适量NOS检测缓冲液(2X),加入等量MilliQ级纯水,混匀即成NOS检测缓
冲液。
检测反应液的配制:检测反应液参考下表配制,即1个反应就配制100微升,10个反应就配制1毫
升。
|
1个反应 |
10个反应 |
20个反应 |
NOS检测缓冲液(2X) |
50微升 |
500微升 |
1毫升 |
MilliQ级纯水 |
39.8微升 |
398微升 |
796微升 |
精氨酸溶液 |
5微升 |
50微升 |
100微升 |
0.1mM NADPH |
5微升 |
50微升 |
100微升 |
DAF-FM DA |
0.2微升 |
2微升 |
4微升 |
检测反应液总体积 |
100微升 |
1毫升 |
2毫升 |
参考上表依次加入各种试剂,混匀后即为检测反应液。注意:DAF-FM DA较易下沉,配制时一定要注
意把DAF-FM DA混匀。
3. 样品的检测:
细胞或组织内一氧化氮合成酶的活性检测有如下两种方法:
a. 边刺激边测定。对于短时间药物等刺激(通常2小时以内)可以显著提高一氧化氮合成酶活性的情
况可以使用本方法。
吸尽培养液,加入100微升NOS检测缓冲液。如果是悬浮细胞,可以将96孔板离心后吸去上清,或
将生长良好的细胞直接从培养的器皿中离心收集后按照适当密度用NOS检测缓冲液重悬后,按照
每孔100微升均匀加入到96孔板中。
再加入100微升检测反应液,轻轻混匀。
37℃细胞培养箱内孵育20-120分钟。具体孵育时间因不同的刺激和不同的细胞而不同,需自行摸
索。对于经典的LPS和γ-IFN共同刺激RAW 264.7细胞,诱导一氧化氮合成酶活力的提高,孵育
120分钟后检测,可以观察到刺激前后总的一氧化氮合成酶活力提高6-10倍。
直接取该96孔板用荧光酶标仪检测。以没有细胞的孔为空白对照,激发波长为495nm,发射波长
为515nm。用激光共聚焦显微镜或流式细胞仪也可以进行检测。
b. 先刺激后测定。对于需长时间刺激(通常6小时以上)才可以显著提高一氧化氮合成酶活性的情况
可以使用本方法。
细胞或组织刺激后,吸尽培养液,加入100微升NOS检测缓冲液。如果是悬浮细胞,可以将96孔板
离心后吸去上清,再加入100微升NOS检测缓冲液。
再加入100微升检测反应液,轻轻混匀。
37℃细胞培养箱内孵育20-60分钟。具体孵育时间因不同的刺激和不同的细胞而不同,需自行摸
索。
直接取该96孔板用荧光酶标仪检测。以没有细胞的孔为空白对照,激发波长为495nm,发射波长
为515nm。由于波长的设置和FITC检测时的波长设置非常接近,可以直接使用FITC的设置。用激
光共聚焦显微镜或流式细胞仪也可以进行检测。
4. 样品中特定的一氧化氮合成酶的检测(本步骤可以和上述步骤3同时进行):
无论是边刺激边测定还是先刺激后测定,吸尽培养液后加入100微升含有适当浓度的特定一氧化氮合
成酶抑制剂的NOS检测缓冲液。
再加入100微升检测反应液,轻轻混匀。
37℃细胞培养箱内孵育20-60分钟或20-120分钟。具体孵育时间因不同的刺激和不同的细胞而不同,
需自行摸索。
直接取该96孔板用荧光酶标仪检测。以没有细胞的孔为空白对照,激发波长为495nm,发射波长为
515nm。由于波长的设置和FITC检测时的波长设置非常接近,可以直接使用FITC的设置。用激光共聚
焦显微镜或流式细胞仪也可以进行检测。
5. 一氧化氮合成酶相对活力的计算:如果以没有刺激前样品中一氧化氮合成酶的活力为1,那么刺激
后:
样品中一氧化氮合成酶相对活力=(RFU已刺激-RFU空白)/(RFU未刺激-RFU空白)
RFU, relative fluorescence unit, 即为实际测定得到的相对荧光强度。
6. 特定一氧化氮合成酶相对活力的计算:例如检测时加了iNOS的抑制剂,如果以没有刺激前样品中
一氧化氮合成酶的活力为1,那么刺激后:
样品中iNOS酶相对活力=(RFU已刺激-RFU(抑制剂+已刺激))/(RFU未刺激-RFU(抑制剂+未刺激))
7. 如果使用激光共聚焦显微镜或流式细胞仪进行检测,可以参考上述方法进行。
产品图片
相关产品
相关论文
使用本产品的相关论文:
1. Li MX, Wang YR, Cao JM, Tian GZ, Zhao LH.
To Explore the Double - labelingMethod ofMon itor ing the GHRP Regula tory Function on
[ Ca2+ ] i and NO on Rea l Time in Card iomyocytes
Under LSCM.
J Med Res. Aug 2007,Vol.36 No.8.
2. Cao X, You QD, Li ZY, Guo QL, Shang J, Yan M, Chern JW, Chen ML.
Design and synthesis of 7-alkoxy-4-heteroarylamino-3-quinolinecarbonitriles as dual
inhibitors of c-Src kinase and nitric oxide synthase.
Bioorg Med Chem. 2008 Jun 1;16(11):5890-8.
3. Cao X, You QD, Li ZY, Liu XR, Xu D, Guo QL, Shang J, Chern JW, Chen ML.
The design, synthesis and biological evaluation of 7-alkoxy-4-heteroarylamino-3-
cyanoquinolines as dual inhibitors of c-Src and iNOS.
Bioorg Med Chem Lett. 2008 Dec 1;18(23):6206-9.
4. Zhao F, Wang L, Liu K.
In vitro anti-inflammatory effects of arctigenin, a lignan from Arctium lappa L.,
through inhibition on iNOS pathway.
J Ethnopharmacol. 2009 Apr 21;122(3):457-62.
5. Xiong J, Lu H, Lu K, Duan Y, An L, Zhu C.
Cadmium decreases crown root number by decreasing endogenous nitric oxide, which is
indispensable for crown root primordia initiation in rice seedlings.
Planta. 2009 Sep;230(4):599-610. Epub 2009 Jun 26.
6. Xue L, Xu F, Meng L, Wei S, Wang J, Hao P, Bian Y, Zhang Y, Chen Y.
Acetylation-dependent regulation of mitochondrial ALDH2 activation by SIRT3 mediates
acuteethanol-induced eNOS activation.
FEBS Lett. 2012 Jan 20;586(2):137-42.
7. Zhuang XY, Zhang W, Pang XF, Wu WB, Qu WJ.
Combined effect of total flavonoids from seed residues of Hippophae rhamnoides L. and
zinc on advanced glycation end products-induced endothelial cell dysfunction.
Food Chemistry,2012Aug,133(3),906-911.
8. Song S, Zhou F, Chen WR, Xing D.
PDT-induced HSP70 externalization up-regulates NO production via TLR2 signal pathway in
macrophages.
FEBS Lett. 2013 Jan 16;587(2):128-35. doi: 10.1016/j.febslet.2012.11.026.
Epub 2012 Dec 14.
9. Kang H, Liu M, Fan Y, Deng X.
A potential gravity-sensing role of vascular smooth muscle cell glycocalyx in altered
gravitational stimulation.
Astrobiology. 2013 Jul;13(7):626-36. doi: 10.1089/ast.2012.0944. Epub 2013 Jul 12.
10. Wang H, Xiao W, Niu Y, Jin C, Chai R, Tang C, Zhang Y.
Nitric oxide enhances development of lateral roots in tomato (Solanum lycopersicum L.)
under elevated carbondioxide.
Planta. 2013 Jan;237(1):137-44. doi: 10.1007/s00425-012-1763-2. Epub 2012 Sep 19.
11. Chen J, Zhang HQ, Hu LB, Shi ZQ.
Microcystin-LR-induced phytotoxicity in rice crown root is associated with the
cross-talk between auxin and nitricoxide.
Chemosphere. 2013 May 29. pii: S0045-6535(13)00704-2. doi: 10.1016/j.chemosphere.
2013.04.079.
12.Yao J, Pan D, Zhao Y, Zhao L, Sun J, Wang Y, You QD, Xi T, Guo QL, Lu N.
Wogonin prevents lipopolysaccharide-induced acute lung injury and inflammation in mice
via peroxisome proliferator-activated receptor gamma-mediated attenuation of the nuclear
factor-kappaB pathway.
Immunology. 2014 Oct;143(2):241-57. doi: 10.1111/imm.12305.
13.Zhou Y, Chen S, Ding R, Yao W, Gao X.
Inflammatory modulation effect of glycopeptide from Ganoderma capense (Lloyd) Teng.
Mediators Inflamm. 2014;2014:691285. doi: 10.1155/2014/691285. Epub 2014 May 22.
14.Tong L, Chen T, Chen Z, Zhang P, Pi H, Ruan H, Wu J.
Anti-inflammatory activity of omphalocarpin isolated from Radix Toddaliae Asiaticae.
J Ethnopharmacol. 2014 Sep 29;155(3):1553-60. doi: 10.1016/j.jep.2014.07.055. Epub
2014 Aug 4.
苏ICP备06009238号 |