|
|||||||||
产品简介
产品简介:
| 产品编号 | 产品名称 | 产品包装 | 产品价格 |
D0005 |
50次 |
128.00元 |
碧云天的质粒小量抽提试剂盒(Plasmid Mini Preparation Kit)是一种用于从大肠杆菌中进行小量质粒的快速抽提的试剂盒。
本试剂盒采用了一种新型的离子交换柱。在特定条件下,使质粒能在离心过柱的瞬间,结合到质粒纯化柱上,在一定条件下又能将质粒充分洗脱,从而实现质粒的快速纯化。无需酚氯仿抽提,无需酒精沉淀,12个样品只需不足30分钟即可完成。
每个质粒纯化柱可以结合的质粒量的上限约为20微克。每个纯化柱可用于抽提1-5毫升用LB培养过夜的大肠杆菌。抽提所得质粒的OD值一般在1.80左右。抽提获得的质粒量会受质粒拷贝数等因素影响。抽提获得的质粒DNA的OD值也会因菌种不同等原因而略有波动。
由本试剂盒抽提所得的质粒可直接用于转染细胞,DNA测序,PCR,基于PCR的突变,体外转录,转化细菌,内切酶消化等。由本试剂盒抽提所得的质粒可以转细胞,但效果一般,可以用作质粒在细胞内表达的初步检测。为取得最佳的质粒转细胞效果,建议使用碧云天生产的(D0018)质粒中量抽提试剂盒或(D0026)质粒大量抽提试剂盒。
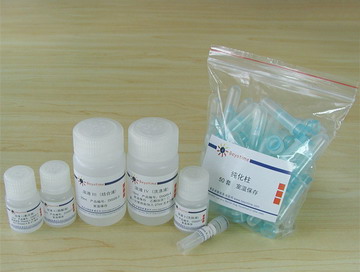
包装清单:
| 产品编号 | 产品名称 | 包装 |
| D0003-1 | 溶液I (悬浮液) | 55ml |
| D0003-2 | 溶液II (裂解液) | 55ml |
| D0003-3 | 溶液III (结合液) | 80ml |
| D0003-4 | 溶液IV (洗涤液) | 36ml×2(第一次使用前每瓶加入54ml无水乙醇) |
| D0003-5 | 溶液V (洗脱液) | 12ml |
| D0003-6 | RNase A (100mg/ml) | 55微升 |
| D0003-7 | 小抽质粒纯化柱及废液收集管 | 200套 |
| — | 说明书 | 1份 |
保存条件:
室温保存,一年有效。
注意事项:
第一次使用前把试剂盒提供的RNase A全部加到溶液I(悬浮液)中,混匀,并在瓶上做好标记。加入RNase A后4℃存放。
第一次使用前在每瓶溶液IV(洗涤液)中加入54ml无水乙醇,混匀,并在瓶上做好标记。
温度较低时,溶液II和溶液III可能会有沉淀产生。使用前必须检查一遍。如有沉淀,37℃水浴加热溶解,混匀后使用。溶液II请勿过分剧烈混匀,否则会产生大量气泡。
溶液II使用完后,一定要盖紧瓶盖,防止被空气中二氧化碳酸化。
溶液II有强碱性,溶液II和溶液III对人体有刺激性,操作时请小心,并注意适当防护以避免直接接触人体或吸入体内。
本试剂盒所有操作均在室温进行,操作时无需冰浴。所有离心也均在室温进行。
废液收集管在一次抽提中需多次使用,切勿中途丢弃。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明
使用说明:
1.取过夜菌1.5毫升,5000g离心1分钟收集细菌沉淀,弃上清。再重复一次,每管共收集3毫升过夜菌沉淀。
通常大肠杆菌宜用LB培养过夜(16小时左右)至OD值为2-4。建议5000g(通常为5000rpm左右)室温离心1分钟,如沉淀不充分则适当延长离心时间。时间过长或离心速度过快会使沉淀过于紧密,不利于加入溶液I后散开沉淀。直接倒掉上清,再倒入约1.5毫升菌液并重复上述操作,然后倒置于吸水纸上(可用普通草纸),使液体流尽。如果细菌密度明显偏低,可考虑使用更多菌液,再重复上述操作1-2次。对于高拷贝质粒所用菌量一般不能超过5毫升,对于低拷贝质粒所用菌量一般不能超过10毫升。过量的细菌会导致后续的裂解不充分。
2.每管加入250微升溶液I,重悬细菌沉淀。确保沉淀完全散开,无可见细菌团块。
确认溶液I中已经添加了RNase A。最高速度vortex 5-10秒或更长时间,悬起沉淀。一定要充分混匀,对着光亮处观察应呈均匀的悬浊液,无明显细菌团块或絮块。如果没有vortex,可以用枪吹打沉淀使沉淀逐渐散开或用手指把沉淀弹开。
3.每管加入250微升溶液II,轻轻颠倒离心管4-6次,使细菌完全裂解,溶液透明。
切勿vortex!vortex或其它剧烈操作会导致基因组DNA断裂,易导致最终所得质粒被基因组DNA污染。颠倒4-6次后,溶液应变得透明,无团块或絮状物。如果加入溶液I后细菌没有完全散开,那么颠倒4-6次后,可能还会有团块或絮状物。遇到有少量团块或絮状物产生的情况,可以增加颠倒次数3-5次,再室温放置2-3分钟,但总裂解时间不可超过5分钟。
4.每管加入350微升溶液III,随即颠倒离心管4-6次混匀,可见白色絮状物产生。
切勿vortex!颠倒次数也不宜过多,否则易导致最终所得质粒的质量下降。
5.最高速(13,000rpm左右)室温离心10分钟。
离心后会产生白色沉淀。离心时准备好下一步需使用的质粒纯化柱,废液收集管,并在纯化柱上做好标记。
6.将上一步骤离心后的上清倒入或吸入到质粒纯化柱内。最高速离心30-60秒,倒弃收集管内液体。
质粒倒入质粒纯化柱后,可以不用等待,直接离心。倒弃收集管内的液体后,保留收集管继续使用。
7.在质粒纯化柱内加入750微升溶液IV,最高速离心30-60秒,洗去杂质,倒弃收集管内液体。
加入溶液IV后可以不用等待,直接离心。倒弃收集管内的液体后,保留收集管继续使用。
8.再最高速离心1分钟,除去残留液体并使痕量乙醇完全挥发。
注意:倒弃收集管内液体后再离心,才能彻底去除微量的溶液IV。微量的溶液IV会影响质粒的质量。
9.将质粒纯化柱置于1.5毫升离心管上,加入50微升溶液V至管内柱面上,放置1分钟。
溶液V需要直接加至管内柱面中央,使液体被纯化柱吸收。如果不慎将溶液V沾在管壁上,一定要震动离心管,使液体滑落到管底,以便被纯化柱吸收。也可以用重蒸水或 Milli-Q级纯水替代溶液V,但是水的pH应不小于6.5。溶液V加入后放置时间稍长,对于增加质粒产量会略有帮助。
10.最高速离心1分钟,所得液体即为高纯度质粒。
通常所得质粒浓度为0.1-0.3mg/ml左右。如果想得到高浓度的质粒,可以采用常规的乙醇沉淀方法浓缩质粒。
产品图片
相关产品
相关论文
使用本产品的相关论文:
1. Jin-Feng Sun, Min Xu, Feng Zhang and Zheng-Xiang Wang.
Novel recombinant Escherichia coli Producing ethanol from glucose and xylose.
Acta Microbiol Sinica. 2004, 44(5): 600-604.
2. Jin Ding, Jun Liu, Cai-Fang Xue, Ying-Hui Li, Ya Zhao, Jun Chen, Yu-Xiao Huang,
Zhong-Xiang Liu.
TatPTD can introduce HBV targeted ribonuclease into hepatocytes.
World Chin J Digestol. 2005 april 15;13(8):958-962.
3. Wu Y, Wang XJ, Liu XM, Zeng CY, Liang XQ.
Recombinant PIG11 Gene Retroviral Vector Construction and
Its High Expression in HepG2
Cells.
Journal of Nanhua University(Medical Edition).2007 Sep.Vol.35 No.5.
4. Wang F, Huang K, Yang L, Gong J, Tao Q, Li H, Zhao Y, Zeng S, Wu X, St?ckigt J, Li X,
Qu J.
Preparation of C-23 esterified silybin derivatives and evaluation of their lipid
peroxidation inhibitory and DNA protective properties.
Bioorg Med Chem. 2009 Sep 1;17(17):6380-9. Epub 2009 Jul 18.
5. Jing RR, Cui M, Sun BL, Yu J, Wang HM.
Tissue-specific expression profiling of receptor for advanced glycation end products
and itssoluble forms in esophageal and lung cancer.
Genet Test Mol Biomarkers. 2010 Jun;14(3):355-61.
6. Yongjin J. Zhou, Fan Yang, Sufang Zhang, Haidong Tan and Zongbao K. Zhao
Efficient gene disruption in Saccharomyces cerevisiae using marker cassettes with long
homologous arms prepared by the restriction-free cloning strategy
WORLD JOURNAL OF MICROBIOLOGY AND BIOTECHNOLOGY,2011, 27(12),2999-3000
7. Zhou Y, Wang L, Yang F, Lin X, Zhang S, Zhao ZK
Determining the extremes of the cellular NAD(H) level by using an Escherichia
coliNAD(+)-auxotrophic mutant.
Appl Environ Microbiol. 2011 Sep;77(17):6133-40.
8. Liang QL, Wang BR, Li ZY, Chen GQ, Zhou Y.
Basic research Construction of eukaryotic expression vector of TSLC1 gene.
Arch Med Sci. 2011 Aug;7(4):579-85.
9. Yang F, Zhang S, Zhou YJ, Zhu Z, Lin X, Zhao ZK.
Characterization of the mitochondrial NAD+ -dependent isocitrate dehydrogenase of
theoleaginous yeast Rhodosporidium toruloides.
Appl Microbiol Biotechnol. 2012 May;94(4):1095-105.
10.Liang QL, Wang BR, Li ZY, Chen GQ, Zhou Y.
Effect of TSLC1 gene on growth and apoptosis in human esophageal carcinoma Eca109 cells.
Arch Med Sci. 2012 Dec 20;8(6):987-92. doi: 10.5114/aoms.2012.31251. Epub 2012 Oct 16.
11.Yang W, Zhou Y, Ke Z.
Production of dihydroxyacetone from glycerol by engineered Escherichia coli cells
co-expressing gldA and nox genes.
Afr. J. Biotechnol.Vol. 12(27), pp. 4387-4392, 3 July, 2013.
12.Wang X, Jiang Q, Wang W, Su L, Han Y, Wang C.
Molecular mechanism of polypeptides from Chlamys farreri (PCF)'s anti-apoptotic effect
in UVA-exposed HaCaT cells involves HSF1/HSP70, JNK, XO, iNOS and NO/ROS.
J Photochem Photobiol B. 2014 Jan 5;130:47-56. doi: 10.1016/j.jphotobiol.
2013.11.005. Epub 2013 Nov 14.
苏ICP备06009238号 |
